ニュースリリースは報道関係者を対象とした、配信時当時の情報を掲載しています。
医療関係者や一般の方々を対象とした医学的な情報提供や、プロモーションを目的としたものではありません。
本資料は、インスメッド(米国 ニュージャージー州)が2024年5月28日(現地時間)に発表したプレスリリースを日本語に翻訳編集したもので、その内容および解釈については、英語原文の記載及び米国における規制等に基づくものが優先されます。本資料は、報道関係者各位へ参考資料として提供するもので、医薬品のプロモーションや宣伝・広告を目的とするものではありません。英語版は、https://investor.insmed.com/2024-05-28-Insmed-Announces-Positive-Topline-Results-from-Landmark-ASPEN-Study-of-Brensocatib-in-Patients-with-Bronchiectasisをご参照ください。
インスメッド®、気管支拡張症患者を対象としたブレンソカチブの画期的なASPEN試験の良好なトップラインの結果を発表
-
国際共同第III相試験において、ブレンソカチブは10mgおよび25mgの両用量で主要評価項目を達成し、肺疾患増悪発生頻度のプラセボに対する統計学的に有意な減少及び臨床的に意義のある減少を示した。
-
ブレンソカチブの投与は、複数の副次的評価項目においても両用量でプラセボに対する統計学的有意性を示した。
-
ブレンソカチブは両用量で良好な忍容性を示した。
-
ASPEN試験の結果、ジペプチジルペプチダーゼ1(DPP1)阻害が、好中球性炎症を介する様々な疾患の治療に用いられる可能性を有する新たな作用機序であることが確認された。
-
インスメッドは米国での薬事申請に向けて迅速に進める計画であり、承認が得られれば2025年半ばに米国での発売を見込む。
-
インスメッドは2024年5月28日(火)午前8時(米国東部時間)に投資家向けカンファレンスコールを開催した。
2024年5月28日、米国ニュージャージー発
深刻な希少疾患と生きる患者さんの未来を変えることを使命とするグローバルバイオ医薬品企業のインスメッド(Nasdaq: INSM)は、本日、非嚢胞性線維症気管支拡張症(NCFBE)患者を対象としたブレンソカチブの有効性・安全性・忍容性を評価する、第III相無作為化二重盲検プラセボ対照国際共同試験であるASPEN試験のトップラインの結果が良好であったことを発表しました。本試験は主要評価項目を達成し、ブレンソカチブの両用量において、年率換算した肺疾患増悪(PEs)の発生率のプラセボに対する統計学的に有意な減少を示しました。また、本試験は、複数の事前に規定された副次的評価項目においても統計学的有意性を示しました。
これらの結果に基づき、インスメッドは2024年第4四半期に気管支拡張症患者を対象としたブレンソカチブの新薬承認申請を米国食品医薬品局(FDA)に提出する予定です。規制当局の承認が得られた場合、インスメッドは2025年半ばに米国でブレンソカチブを発売し、その後2026年前半に欧州と日本で発売する予定です。承認されれば、ブレンソカチブは気管支拡張症患者に対し初めて承認された治療薬となり、ジペプチジルペプチダーゼ1(DPP1)阻害薬(好中球性炎症を介する様々な疾患の治療に用いられる可能性を有する新たな作用機序)としても初めての承認となります。
ASPEN試験における有効性のトップラインの結果は以下の通りです。
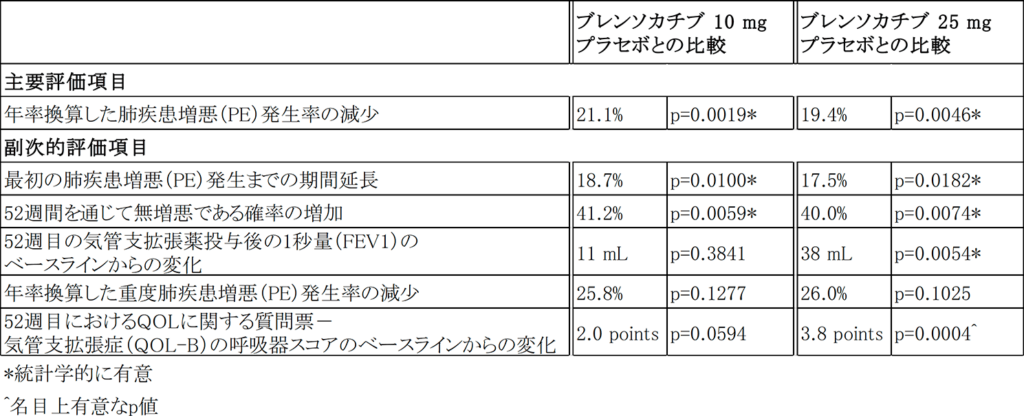
「ASPEN試験において、ブレンソカチブがプラセボと比較して統計学的に有意かつ臨床的に意義のある治療効果を示し、この治験薬が気管支拡張症患者にもたらす可能性がある効果を明確に示すことができ、大変嬉しく思います。」と、英国ダンディー大学医学部教授で呼吸器内科顧問の治験責任医師James Chalmers氏(MBChB, Ph.D.)は述べたうえで、「現在、気管支拡張症の治療薬として承認されているものはなく、増悪を抑える治療薬の開発が急務となっています。DPP1阻害薬であるブレンソカチブは、このクラス初の治療薬であり、この治療困難な患者さんの治療に全く新しいアプローチを提供し、気管支拡張症の臨床管理に新しい時代の到来を告げることができるでしょう。」と述べています。
ASPEN試験の実施に伴い、約40カ国で460以上の治験実施医療機関が関与しました。患者を登録しなかった施設とウクライナの全施設を除くと、ASPENの実施医療機関の総数は35カ国で391施設になります。成人患者(18~85歳)を1:1:1に、青年患者(12~18歳未満)を2:2:1に無作為に割り付け、ブレンソカチブ10mg、ブレンソカチブ25mg、またはプラセボを1日1回52週間投与し、その後4週間休薬しました。主要な有効性の解析には、成人患者1,680例及び青年患者41例のデータが含まれます。
本試験においてブレンソカチブは良好な忍容性を示しました。いずれの用量のブレンソカチブを投与された患者でも少なくとも5.0%に発現し、プラセボよりも頻度が高かった試験治療下で発現した有害事象(TEAEs)は、COVID-19(15.8%、20. 9%、15.8%)、鼻咽頭炎(7.7%、6.3%、7.6%)、咳嗽(7.0%、6.1%、6.4%)、頭痛(6.7%、8.5%、6.9%)でした。その他のTEAEsおよび試験治療下で発現した特に注目すべき有害事象(TEAESIs)は以下の通りになります。

インスメッドの最高医学責任者(CMO)である マルティナ・フラマー(M.D., M.B.A.)は、「ASPEN試験から得られたトップラインの結果、そしてそれが患者さんにとってどのような意味を持つのかを考えると、大変嬉しく思います。これらの結果は、ブレンソカチブが気管支拡張症の治療状況を一変させる可能性があるという私たちの信念を裏付けるだけでなく、DPP1阻害が他の好中球を介する疾患でも有望な作用機序であることをさらに証明するものです。」と述べたうえで、「本日の結果は、インスメッドチームの多くのメンバーによる長年の努力と献身の結果であり、その努力に感謝します。そして、この臨床試験を可能にした治験担当医師、施設スタッフ、患者さん、ご家族の皆さんに感謝申し上げます。私たちは今後、データの解析を進めるとともに、主要地域における承認申請に向けて迅速に前進してまいります。承認された治療により、約100万人の気管支拡張症患者が恩恵を受ける可能性があると考えています。」と述べています。
ブレンソカチブは、FDAから画期的治療薬指定(Breakthrough Therapy Designation)を受け、欧州医薬品庁から気管支拡張症患者を対象とした優先医薬品(PRIME)スキームへのアクセスが認められました。インスメッドは、今後ASPEN試験の詳細な結果を医学会議で発表する予定です。
インスメッドはまた、健康への負担が大きく治療選択肢が限られている他の好中球を介する炎症性疾患においてもブレンソカチブの開発を進めています。現在、鼻茸を伴わない慢性副鼻腔炎(CRSsNP)患者を対象とした第II相試験が進行中であり、インスメッドは2024年後半に、化膿性汗腺炎(HS)を対象とした第II相試験を開始する予定です。
インスメッドは、2024年6月4日(火)午前8時(米国東部時間)にコマーシャルウェビナーを開催し、当社のコマーシャル・リーダーシップが3つの最先端プログラム、アリケイス®(アミカシン・リポソーム吸入用懸濁液)、ブレンソカチブ、Treprostinil Palmitil Inhalation Powder(TPIP)の市場見通しについて詳細を説明します。
カンファレンスコール
インスメッドは、5月28日午前8時(米国東部時間)よりカンファレンスコールを実施しました。この会議のウェブキャストは、弊社ウェブサイト(www.insmed.com)の投資家情報セクションに90日間保存されます。
気管支拡張症について
気管支拡張症は、炎症、感染、気道粘液クリアランスの異常、肺組織損傷のサイクルにより気管支が不可逆的に拡張する重篤な慢性肺疾患です。この疾患は、抗生物質治療や入院を必要とする肺の増悪が頻繁に起こることが特徴です。症状としては、慢性の咳嗽、過剰な喀痰、息切れ、呼吸器感染の繰り返しなどがあり、基礎疾患を悪化させます。気管支拡張症は、米国で約45万人、欧州で約40万人、日本で約15万人の患者が罹患しており、これらの地域では現在、気管支拡張症に特化した治療薬は承認されていません。
ブレンソカチブについて
ブレンソカチブは、インスメッドが気管支拡張症やその他の好中球介在性疾患の治療薬として開発している低分子の経口ジペプチジルペプチダーゼ1(DPP1)の選択的競合的可逆的阻害薬です。DPP1は、好中球が骨髄で形成される際に、好中球エラスターゼなどの好中球セリンプロテアーゼ(NSP)を活性化する酵素です。好中球は白血球の中で最も多く存在し、病原体の破壊や炎症性媒介において不可欠な役割を担っています。慢性炎症性肺疾患では、好中球が気道に蓄積し、その結果、過剰に活性化したNSPが肺の破壊と炎症を引き起こします。ブレンソカチブは、DPP1およびそのNSPの活性化を阻害することにより、気管支拡張症などの炎症性疾患への損傷作用を低下させることが期待されます。現在、ブレンソカチブは開発治験段階にあり、世界中のどの国・地域においても、承認されていません。
インスメッドについて
グローバルバイオ医薬品企業であるインスメッドは、深刻な希少疾患と生きる患者さんの未来を変えることを使命としています。インスメッドは初めての製品として、米国、欧州、日本において、難治の慢性肺疾患に対する初の治療薬を上市しました。インスメッドは好中球が関与する炎症性疾患や希少肺疾患など深刻なアンメットニーズを有する疾患に対する研究開発に注力しています。インスメッドは、米国ニュージャージー州ブリッジウォーターに本社を置き、欧州や日本において事業を展開しています。
日本法人概要
会社名:インスメッド合同会社
設立日:2017年12月5日
住所:〒100-0014 東京都千代田区永田町2-10-3 東急キャピトルタワー13階
https://insmed.jp/
Insmed®, Insmed logo, インスメッド®, アリケイス® are registered trademarks of Insmed Incorporated.
将来予想に関する記述
本プレスリリースには、1995 年米国民事証券訴訟改革法で定義されている「将来予想に関する記述」が含まれており、歴史的事実ではない記述であり、多くのリスクや不確定要素を伴っています。本プレスリリース記載の「かもしれない」、「予定する」、「はずである」、「可能性がある」、「だろう」、「期待する」、「計画する」、「見込む」、「信じる」、「見積もる」、「想定する」、「予測する」、「予定する」、「可能性がある」、「継続する」およびその他同様の表現(ならびに将来の事象、条件、状況に言及しているその他の言葉や表現)は、将来予想に関する記述であることを示しています。本プレスリリースに記載されている将来予想に関する記述は、当社の現時点での予測や見解に基づくものであり、既知および未知のリスク、不確定要素およびその他の要因を伴っています。これらの要因により、当社の実際の業績、実績、成果および特定の事象の発生時期が、将来予想に関する記述で検討、予測、予想または提示されているそれらと大きく異なる可能性があることをご留意ください。これらのリスク、不確定要素およびその他要因には、以下のものが含まれます。アリケイスもしくは、当社の製品候補についての規制当局による承認を取得できないこと、またはその取得が遅延すること。既承認薬であるアリケイスの商業化の失敗、またはアリケイスの現在の薬事承認維持の失敗。自然災害または新型コロナウイルス感染症(COVID-19)のような公衆衛生上の緊急事態を含む大災害やその他の事象による事業または経済活動の混乱。アリケイスまたは当社の製品候補に対して予測せぬ安全性または有効性に関する懸念事項の発生。当社によるアリケイスまたはその他製品候補の潜在的な市場規模予測が不正確であること。当社または当社の他の製造委託先が薬事規制要件を遵守できないこと。当社がアリケイスに対する適切な償還を得られないこと、または許容できる薬価を得られないこと。当社の新規遺伝子治療製品候補の開発、規制当局の薬事承認および商業化に要する時間および費用を正確に予測できないこと。当社が委託している第三者による失敗。当社の実施する買収が失敗する、または商業的に成功しないリスク。米国、欧州、日本および全世界における一般的な経済状況の悪化(長期的なインフレの影響を含む)。当社が知的財産権を適切に保護できないこと。アリケイス、または当社の製品候補に関連する契約により当社に課される制限またはその他の義務の発生。当社の継続的な営業損失、および当社が収益性を達成または維持できない可能性。当社の既存債務の返済能力および将来の資金調達能力に関する不確実性。第三者製造施設の追加建設に関連するリスク。 将来予想に関する記述は、将来発生するまたは発生しない可能性のある事象に関連し、かつその性質上、将来発生するまたは発生しない可能性のある状況に依存するため、当社が将来予想に関する記述で示した実績、計画、意図、または予測を実際に達成できない場合があります。当社の事業に影響を及ぼすリスクや不確定要素に関する追加情報については、2023年12月31日を期末とするインスメッド年次報告書(Form 10-K)およびそれ以降に米国証券取引委員会(SEC)に提出している書類に記載されている Item 1A「リスク要因(Risk Factors)」で説明されている要因をご覧ください。 将来予想に関する記述は、あくまでも公表日現在における発表であるため、それらに過度に依拠することのないようご注意ください。当社は、法律および米国証券取引委員会(SEC)の規則で特に定められている場合を除き、将来予想に関する記述を公に更新または修正する義務を負いません。