ニュースリリースは報道関係者を対象とした、配信時当時の情報を掲載しています。
医療関係者や一般の方々を対象とした医学的な情報提供や、プロモーションを目的としたものではありません。
この資料は、インスメッド(米国 ニュージャージー州)が2025年5月8日(現地時間)に発表した内容を日本語に翻訳(要約)したもので、参考資料として提供するものです。資料の内容および解釈については、米国における規制等に基づくもの及び英語による記載が優先されます。英語版および関連財務表は、https://insmed.comをご参照下さい。
インスメッド®、2025年第1四半期業績、ならびにビジネスアップデート発表
- アリケイス®(アミカシンリポソーム吸入用懸濁液)*の2025年第1四半期の売上高は9,280万ドルで、2024年第1四半期と比較し23%の成長を反映。
- 気管支拡張症患者を対象としたブレンソカチブの新薬承認申請(NDA)は予定通り進行しており、処方薬ユーザー・フィー法(PDUFA)の目標終了期日は2025年8月12日。
- 肺動脈性肺高血圧症(PAH)患者を対象としたTPIPの第Ⅱb相試験が完了し、トップラインデータは2025年6月に得られる見込み。
- 鼻茸を伴わない慢性副鼻腔炎(CRSsNP)患者を対象としたブレンソカチブの第Ⅱb試験(BiRCh試験)の患者登録が完了し、トップラインデータは2025年末までに得られる見込み。
- 気管支拡張症患者を対象としたブレンソカチブの販売承認申請(MAA)が欧州医薬品庁(EMA)および英国医薬品・医療製品規制庁(MHRA)により受理。
- 2025年のグローバルでのアリケイス売上予想レンジを4億500万ドルから4億2,500万ドルとし、2024年に比べて2桁成長を反映。
*日本ではアリケイス吸入液590mg(アミカシン硫酸塩 吸入用製剤)として承認されています。
2025年5月8日、米国ニュージャージー州発 人を第一に考え、深刻な疾患と生きる患者さんの未来を変える、ファースト・イン・クラスおよびベスト・イン・クラスの治療法の実現を目指すグローバルバイオ医薬品企業のインスメッド(Nasdaq: INSM)は、2025年3月31日に終了した第1四半期の業績、ビジネスアップデートを発表しました。
インスメッド会長兼最高経営責任者(CEO)のウィル・ルイスは、「2025年第1四半期において、インスメッドはコマーシャルおよび臨床開発プログラムにおいて優れた実行力を示すとともに、肺動脈性肺高血圧症(PAH)を対象としたTPIPの第Ⅱ相試験データの公表や、期待される気管支拡張症を対象としたブレンソカチブの米国食品医薬品局(FDA)による承認など、近い将来に控えるマイルストーンに向けた準備を同時に進めてきました。」と述べた上で、「規制環境が変化する中で、ブレンソカチブのFDA審査プロセスは順調に進行しており、当社の成功を待ち望む患者の皆さまに円滑な製品上市をお届けできるよう、全力で準備を進めています。この勢いは今後も継続すると見込んでおり、2025年末までには鼻茸を伴わない慢性副鼻腔炎(CRSsNP)を対象としたブレンソカチブの第Ⅱ相BiRCh試験のデータ、さらに2026年前半にはすべての肺MAC症患者を対象としたアリケイスの第Ⅲ相ENCORE試験のデータを公表する予定です。これらの重要な転換点を前に、当社のビジョン実現に向けて努力を惜しまないインスメッドチームを、私は誇りに思っています。」と述べています。
| 最近の主なハイライト |
| アリケイス |
|
| ブレンソカチブ |
|
| TPIP |
|
| 遺伝子治療 |
|
| 前臨床プログラム |
|
| コーポレートアップデート |
|
| 2025年第1四半期および通期の業績について |
|
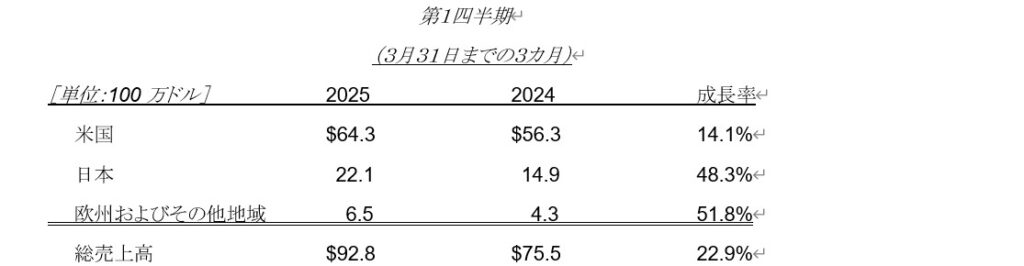
- 売上原価(無形資産償却費を除く)は、2025年第1四半期に2,130万ドル、2024年第1四半期は1,750万ドルでした。売上原価の増加は、主にアリケイスの売上高の伸びを反映したものです。
- 研究開発(R&D)費用は、2025年第1四半期が1億5,260万ドル、2024年第1四半期が1億2,110万ドルでした。R&D費用の増加は、主に人員増に伴う報酬および福利厚生関連費用の増加、株式報酬費用の増加、さらには製造費用の増加によるものです。
- 2025年第1四半期の販売および一般管理費(SG&A)は、2024年第1四半期の9,310万ドルに対し1億4,750万ドルでした。SG&A費用の増加は、主に米国でのブレンソカチブの規制当局承認を前提とした発売準備に伴う人員増加による報酬および福利厚生関連費用の増加、および株式報酬費用の増加によるものです。
- 2025年第1四半期の純損失は2億5,660万ドル(1株あたり1.42ドル)で、2024年第1四半期の純損失は1億5,710万ドル(1株あたり1.06ドル)でした。
| 貸借対照表、財政ガイダンス、計画投資について | |
|
カンファレンスコール
インスメッドは、2025年5月8日午前8時(米国東部時間)よりカンファレンスコールを実施しました。この会議のウェブキャストは、当社ウェブサイト(www.insmed.com)の投資家情報セクションに90日間保存されます。
アリケイスについて
アリケイスは、米国ではARIKAYCE®(Amikacin Liposomal Inhalation Suspension/ALIS, アミカシンリポソーム吸入用懸濁液)、欧州ではARIKAYCE® Liposomal 590mg Nebuliser Dispersion、日本ではアリケイス®吸入液590mg(アミカシン硫酸塩 吸入用製剤)として承認されています。現在、国際的な治療ガイドラインでは、適切な患者にアリケイスを使用することが推奨されています。アリケイスは、これまで静脈内投与され、聴覚、平衡感覚、および腎機能に対する重度の毒性を示す抗菌薬であるアミカシンを、1日1回、吸入投与する新規製剤です。当社独自のPULMOVANCE®リポソーム技術により、アミカシンを肺に直接到達させることで、全身の曝露を抑えながら、主要な感染細胞である肺マクロファージに取り込まれることを可能としました。アリケイスは、PARI Pharma GmbH(以下、PARI社)社製のラミラ® ネブライザシステムを使用して1日1回投与されます。
PARI社とラミラ®ネブライザシステムについて
アリケイスは、PARI社が開発した新しい吸入器であるラミラ®ネブライザシステムによって投与されます。ラミラ®は、振動する多孔質膜を介してアリケイスを効率的に噴霧することができる、静かで持ち運び可能なネブライザです。PARI社は、エアロゾルに関する100年の知見に基づき、患者の治療を向上させるための革新的な送達プラットフォームの開発を通じて、吸入治療の進歩に貢献しています。
ブレンソカチブについて
ブレンソカチブは、インスメッドが気管支拡張症、鼻茸を伴わない慢性副鼻腔炎、化膿性汗腺炎、その他の好中球を介する疾患の治療薬として開発している低分子の可逆的経口ジペプチジルペプチダーゼ1(DPP1)阻害剤です。DPP1は、好中球が骨髄中で形成される際に、好中球エラスターゼなどの好中球セリンプロテアーゼ(NSP)を活性化する酵素です。好中球は白血球の中で最も多く存在し、病原体の破壊や炎症性媒介において不可欠な役割を担っています。慢性炎症性肺疾患では、好中球が気道に蓄積し、その結果、過剰に活性化したNSPが肺の破壊と炎症を引き起こします。ブレンソカチブは、DPP1およびDPP1によるNSPの活性化を阻害することにより、気管支拡張症などの炎症性疾患が及ぼす損傷作用を低下させることが期待されます。現在、ブレンソカチブは開発治験段階にあり、世界中のどの国・地域においても、承認されていません。
TPIPについて
Treprostinil palmitil inhalation powder(TPIP)は、炭素数16の炭素鎖にエステル結合で結合したトレプロスチニルで構成される、トレプロスチニルのプロドラッグであるトレプロスチニルパルミチルの乾燥粉末製剤です。TPIPは、当社の研究所で最初から開発された、PAH、PH-ILD、その他の希少かつ重篤な肺疾患患者の治療薬としての評価が行われている、将来が非常に期待される高度に差別化されたプロスタノイドです。TPIPは、カプセル製剤であり、吸入器を使用して投与されます。現在、TPIPは開発治験段階にあり、世界中のどの国・地域においても、承認されていません。
INS1201について
INS1201は、デュシェンヌ型筋ジストロフィーの患者に対する治療法として、当社が開発を進めているマイクロジストロフィンを発現するAAV(アデノ随伴ウイルス)遺伝子補充療法です。本剤は髄腔内投与により投与され、低用量で骨格筋および心筋の両方を標的としています。現在、INS1201は、世界中のどの国・地域においても、承認されていません。
インスメッドについて
人を第一に考えるグローバルバイオ企業であるインスメッドは、深刻な疾患と生きる患者さんの未来を変える、ファースト・イン・クラスおよびベスト・イン・クラスの治療法の実現を目指しています。当社は既承認薬から、中期から後期開発段階にある治験薬、最もニーズの高い患者コミュニティに提供する先進的な創薬まで、多様なポートフォリオを推進しています。インスメッドの最も進んだ段階にあるプログラムは、米国・日本・欧州で承認された慢性的で衰弱しやすい肺疾患の治療をはじめとする肺疾患と炎症性疾患に関するものです。当社の初期段階の研究プログラムは、遺伝子療法、AIを用いたタンパク質工学、タンパク質製造、RNA端末結合、合成救済など、幅広い技術とモダリティを網羅しています。インスメッドは、米国ニュージャージー州ブリッジウォーターに本社を置き、欧州や日本において事業を展開しています。インスメッドはScience誌のトップエンプロイヤーサーベイで4年連続1位に選ばれ、バイオ医薬品産業で優良企業の1つとして認められています。
日本法人概要
会社名 : インスメッド合同会社
設立日 : 2017年12月5日
住所 : 〒100-0014 東京都千代田区永田町2-10-3 東急キャピトルタワー13階
https://insmed.jp/
Insmed®, Insmed logo, インスメッド®, ARIKAYCE®, アリケイス® are registered trademarks of Insmed Incorporated. PARI® is a registered trademark of PARI GmbH.ラミラ® is registered trademarks of PARI Pharma GmbH. All other trademarks referenced herein are the property of their respective owners.
将来予想に関する記述
本プレスリリースには、1995年米国民事証券訴訟改革法にいう「将来予想に関する記述」が含まれており、これは歴史的事実ではない記述であり、多くのリスクや不確定要素を伴っています。本プレスリリース記載の「かもしれない」、「予定する」、「はずである」、「可能性がある」、「だろう」、「期待する」、「計画する」、「見込む」、「信じる」、「見積もる」、「想定する」、「予測する」、「予定する」、「可能性がある」、「継続する」およびその他同様の表現(ならびに将来の事象、条件、状況に言及しているその他の言葉や表現)は、将来予想に関する記述であることを示しています。
本プレスリリースに記載されている将来予想に関する記述は、当社の現時点での予測や見解に基づくものであり、既知および未知のリスク、不確定要素およびその他の要因を伴っています。これらの要因により、当社の実際の業績、実績、成果および特定の事象の発生時期が、将来予想に関する記述で検討、予測、予想または提示されているそれらと大きく異なる可能性があることをご留意ください。これらのリスク、不確定要素およびその他要因には、以下のものが含まれます。アリケイスの商業化の失敗、またはアリケイスの現在の規制当局による承認維持の失敗。当社が米国食品医薬品局からアリケイスに対する完全承認を取得できないこと。より広範な患者群を対象としたアリケイスの適応拡大に必要な薬事承認を取得できないこと。ブレンソカチブに関する規制当局による承認を取得できないこと、またはその取得が遅延すること。規制当局により承認されたにもかかわらずブレンソカチブの商業化に成功しないこと。アリケイスまたは(承認された場合)ブレンソカチブの市場受容度の不確実性または変化。アリケイスまたは(承認された場合)ブレンソカチブに対する適切な償還を得られないこと、または許容できる薬価を得られないこと。アリケイス、ブレンソカチブまたはその他の製品候補の潜在的な市場規模予測が不正確であること。当社が製造に関して委託している第三者の失敗。アリケイス、ブレンソカチブまたは当社の他の製品候補に対して予測せぬ安全性または有効性に関する懸念事項の発生。当社が発表する臨床試験の中間データ、トップラインデータもしくは予備データがより多くの患者データが入手可能になるにつれて変化するリスク、または盲検化されたデータから盲検化されていないデータを予測できないリスク。獲得した技術、製品および製品候補が商業的に成功しないリスク。自然災害、公衆衛生上の緊急事態またはサイバーセキュリティ攻撃を含む、大災害またはその他の事象による事業または経済活動の混乱。AIおよび機械学習の現在および将来的な利用が成功しないリスク。米国、欧州、日本および全世界における一般的経済状況の悪化。高額な知的財産に関する紛争に巻き込まれるリスク、または当社の知的財産権を適切に保護できないリスク。当社が当事者である訴訟または当事者となる可能性のある訴訟に起因するコストおよび潜在的なレピュテーションダメージ。当社の事業に適用される法令の変更。過去の営業赤字、および収益性を達成または維持できない可能性。既存債務の返済不能および将来の資本調達能力に関する不確実性。追加的な第三者製造施設の建設計画実行の遅延。
将来予想に関する記述は、その性質上将来発生するまたは発生しない可能性のある事象に関連し、かつ将来発生するまたは発生しない可能性のある状況に依存するため、当社が将来予想に関する記述で示した実績、計画、意図、または予測を実際に達成できない場合があります。当社の事業に影響を及ぼすリスクや不確定要素に関する追加情報については、2024年12月31日を期末とするインスメッド年次報告書(Form 10-K)およびそれ以降に米国証券取引委員会(SEC)に提出している書類に記載されているItem 1A「リスク要因(Risk Factors)」で説明されている要因をご覧ください。
将来予想に関する記述は、あくまでも公表日現在における発表であるため、それらに過度に依拠することのないようご注意ください。当社は、法律および米国証券取引委員会(SEC)の規則で特に定められている場合を除き、将来予想に関する記述を公に更新または修正する義務を負いません。